
Forschung
Neurochirurgisches Forschungslabor
Innovative Forschung neurochirurgischer Krankheitsbilder
Das neurochirurgische Forschungslabor befasst sich seit vielen Jahren mit einem breiten Spektrum an etablierten Techniken zur Erforschung der Krankheitsbilder im Bereich der Neuroonkologie und vaskulären Neurochirurgie.
Unsere Forschung entdecken
Im Neurochirurgischen Forschungslabor widmen wir uns der Untersuchung und Entwicklung neuer therapeutischer Ansätze, um die Behandlung von neurochirurgischen Krankheitsbildern grundlegend beeinflussen zu können. Unsere Arbeit basiert auf einer engen Verbindung zwischen klinischer Neurochirurgie, modernster Forschung und innovativen Technologien. Unser Ziel ist es, neben der Grundlagenforschung einen Bezug zu der klinischen Relevanz herzustellen.
Schwerpunkte
Unsere Forschung ist breit gefächert und umfasst mehrere Kernbereiche, die sich mit den komplexen Herausforderungen der Neurochirurgie befassen. Darunter fällt der Schwerpunkt der Hirntumore sowie der vaskulären Krankheitsbilder, und deren molekularen Veränderungen.
Technologie und Methodik
Wir betreiben translationale Forschung unter Verwendung von Zellkulturen (in vitro), Tiermodellen (in vivo) und operativen Präparaten (patientenbezogenes Material).
Dabei setzen wir auf eine Vielzahl fortschrittlicher Technologien und Methoden, um die komplexen biologischen Prozesse im Gehirn zu verstehen und innovative Therapieansätze zu entwickeln. Unsere Forschung basiert auf modernsten Technologien, die es uns ermöglichen, präzise und tiefgehende Einblicke in die molekularen Mechanismen neurochirurgischer Erkrankungen zu gewinnen.
Neben klassischen Forschungsmethoden wie Echtzeit-RT-PCR, Western Blot, Immunfluoreszenz und anderen Immunfärbungen, wird die ELISA und FACS eingesetzt. In unserem S2-Labor beherrschen wir moderne Technologien für das Gene Editing durch letivirale Transduktion, die einen stabilen Knockdown oder eine Überexpression von Zielgenen vermitteln, sowie die CRISPR-Cas9-Knockout-Technologie.
Unsere Forschung basiert auf modernsten Techniken, die es uns ermöglichen, präzise und tiefgehende Einblicke in die molekularen Mechanismen neurochirurgischer Erkrankungen zu gewinnen.
Neuartige Erkenntnisse unserer Forschung
Publication: 23388056
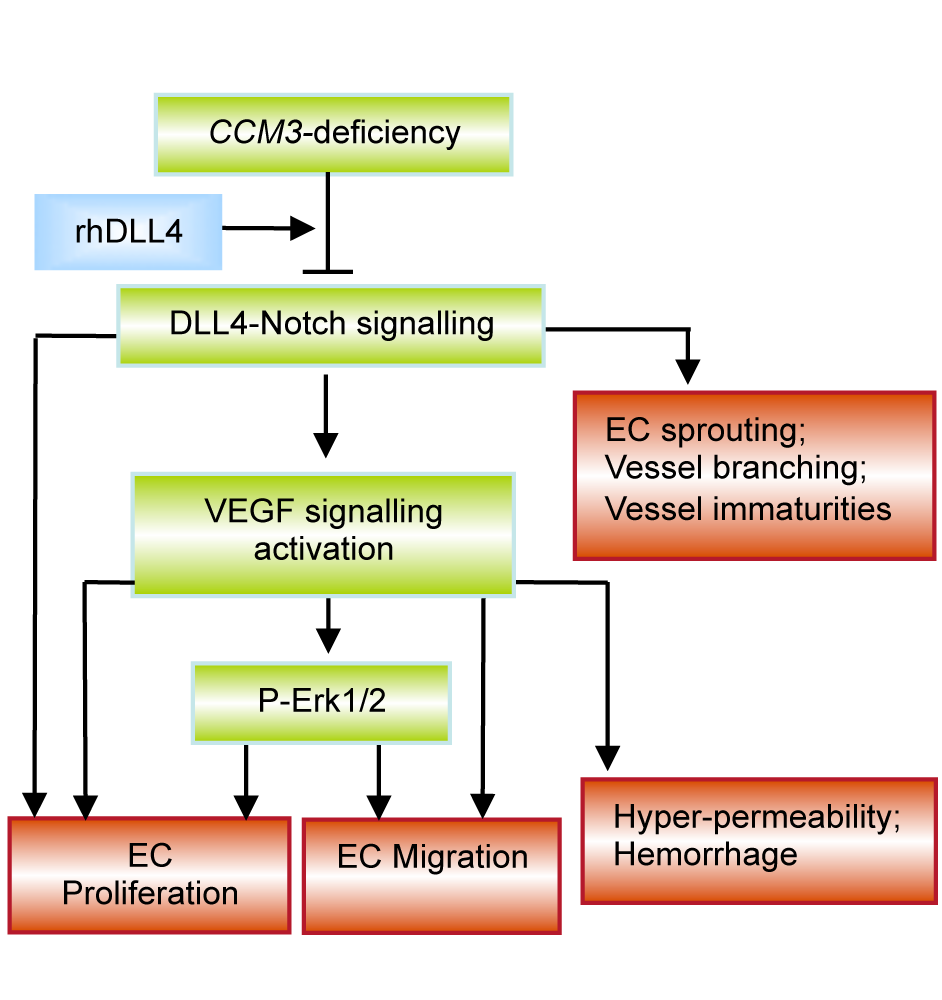
Schematic illustration of the signalling pathways affected by CCM3 deficiency and possible implication in the pathology of cerebral cavernous malformation (CCM).
Loss of CCM3 impaired DLL4-Notch signalling, disrupted the homeostasis of VEGF pathway and activated Erk1/2, which leads to stimulation of endothelial proliferation, migration and sprouting. Treatment with rhDLL4 restored DLL4-Notch signalling, inhibited VEGF and Erk1,2 pathways, and eventually rescued the hyper-angiogenic phenotype induced by CCM3 silencing, suggesting DLL4 as a key downstream modulator in CCM3 endothelial signalling. In addition to angiogenesis, DLL4-Notch signalling and VEGF signalling are well-defined pathways for regulation of vessel ranching/maturation and vessel ermeability respectively. We thus suppose that dysregulation of these pathways may be associated with the impairment of these post-angiogenic functions thereby potentially contributing to the enriched immature angioarchitectures with recurrent haemorrhage typically seen in the lesion of human CCMs. (Publication: PMID: 23388056)
Publication: 32680476

Study the stem cell marker ALDH1A3 in glioblastoma patients: high expression of ALDH1A3 in tumor infiltration area correlates to poor prognosis of GBM patients.
A-a: H&E staining defined tumor center (TC), tumor infiltrative area (TI) and tumor distant area (TD) in GBM patient sections. A-b: The representative image of ALDH1A3 immunostaining. The dominant expression of ALDH1A3 was found in TI and much less in TC. A-c and A-d: Expression of ALDH1A3 (brawn) in tumor vasculature: in out-layer of glomeruloid tufts (A-c) and in some vessels (A-d). B: Semiquantification based on the immunoreactive score (IRS) revealed a significantly higher ALDH1A3 expression in TI than in TC (P < 0.001). C: The association of ALDH1A3 expression with the overall survival (OS) period of GBM patients. A higher expression of ALDH1A3 was significantly associated with a shorter OS time (p < 0.01). (publication: PMID: 32680476)
Publication: 37686698

Schematic illustration of the pro-angiogenic function of ALDH1A3 via paracrine PAI-1 and IL-8 in glioblastoma (GBM) cells.
The overexpression of ALDH1A3 in GBM cells induces upregulation of both PAI-1 and IL-8 at the mRNA and protein levels, resulting in the subsequent release of these proteins into the extracellular compartment. Along with other angiogenic factors, the released PAI-1 and IL-8 exert their effects on ECs, triggering paracrine-mediated hyper-angiogenesis. The application of Tiplaxtinin, a compound that promotes the cleavage of PAI-1, or Reparixin, specific inhibitors of the IL-8 receptor CXCR1/2, effectively counteracted the pro-angiogenic impact caused by ALDH1A3. These findings strongly support the notion that PAI-1 and IL-8 play critical roles as downstream components of ALDH1A3 in GBM, underscoring their significance within the context of angiogenesis. (Publication: PMID: 37686698)
Publication: 39273014
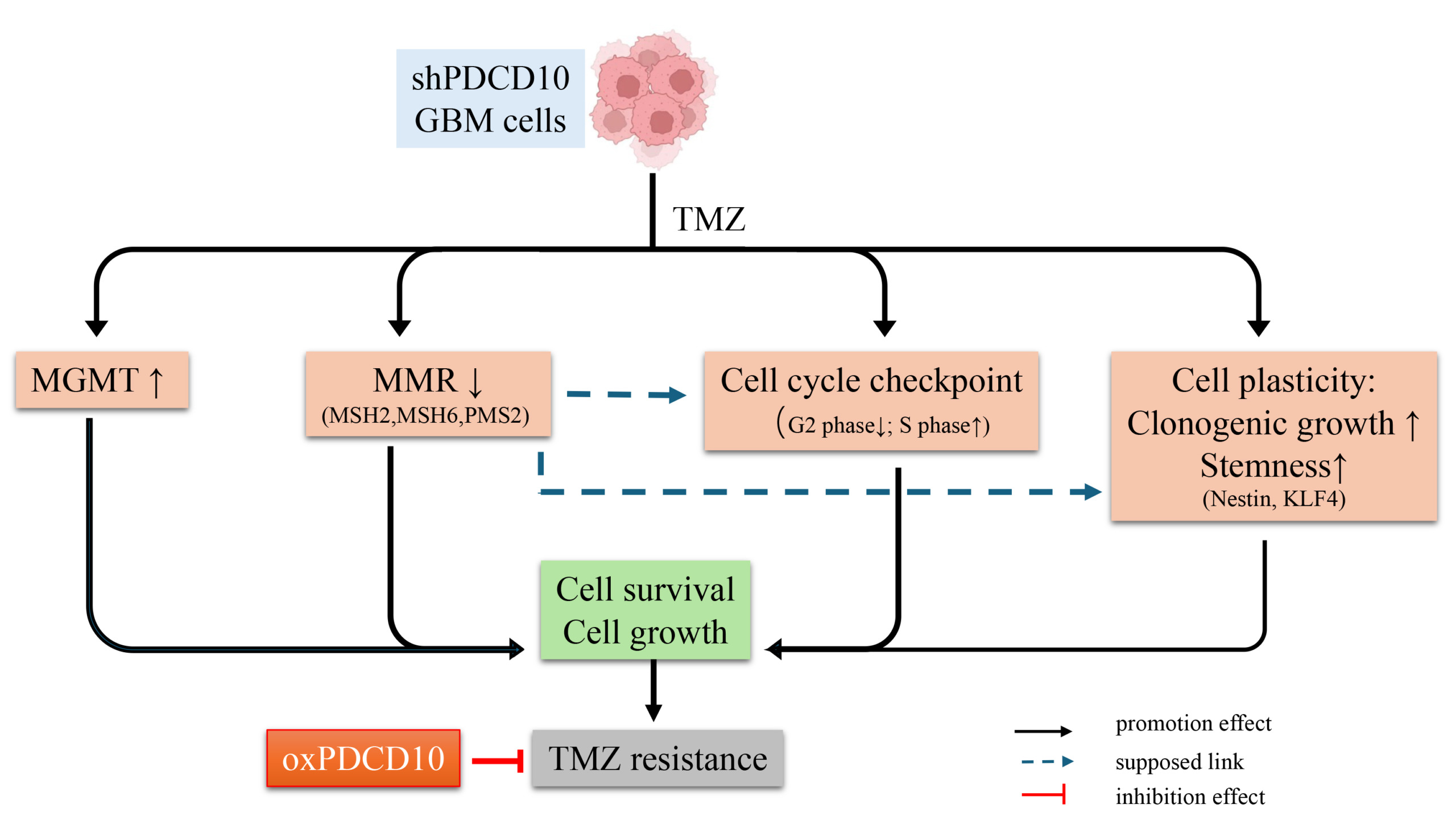
Schematic summary of the role and mechanism of PDCD10 in acquired TMZ-resistance in glioblastoma (GBM).
Knockdown of PDCD10 (shPDCD10) in GBM cells significantly increased cell survival in response to TMZ treatment, and strongly promoted tumor cell regrowth in the post-treatment phase, which collectively accounted for acquired TMZ-resistance. Mechanism studies revealed that the loss of PDCD10 modulated the expression of DNA damage response genes (i.e., upregulating MGMT and downregulating MMR genes MSH2, MSH6, and PMS2), and altered the cell cycle process, as evidenced by the evasion of tumor cells from arrest at the G2/M phase, and the increase in tumor cells in the proliferating S phase. In addition, shPDCD10-GBM cells exhibited higher cell plasticity, as demonstrated by an increased capacity for colony formation and transformation of shPDCD10-GBM cells into GSC-like cells that expressed higher levels of the stem cell markers Nestin and KLF4. In support of these findings, overexpression of PDCD10 (oxPDCD10) induced contrary changes in the molecular and cell behaviors observed in shPDCD10-GBM cells, increasing the sensitivity of oxPDCD10-GBM cells to TMZ treatment and suppressing tumor cell regrowth after TMZ treatment. Our results indicate that PDCD10 plays a pivotal role in acquired TMZ-resistance and thus represents a promising target for perturbing TMZ-resistance and tumor recurrence. (publication: PMID: 39273014)
Sämtliche Publikationen des neurochirurgischen Forschungslabor auf Pubmed
Über uns
Das Neurochirurgische Forschungslabor besteht aus einem hochqualifizierten und interdisziplinären Team von Experten. Unser Team wird von Studenten ergänzt und unterstützt, die die Möglichkeit haben, ihre Promotion bei uns zu erlangen.

Prof. Dr. rer. nat.
Yuan Zhu
Leitung Neurochirurgisches Forschungslabor

Dr.
Igor Cima
Wissenschaftlicher Mitarbeiter
Forschungslabor

Michaela Hiber
MTA

Stefanie Reichel
MTA
